新药研发的风险究竟有多大?以赛诺根制药(SeragonPharmaceuticals,2014年并入全球第二大药厂罗氏)为例,其先前开发的前列腺癌药物ARN-509(Erleada)在强生接手6年后终于在去年获批上市。而当初随赛诺根一起被罗氏纳入旗下的乳腺癌药物ARN-810却在投入近20亿美元后被中止临床。
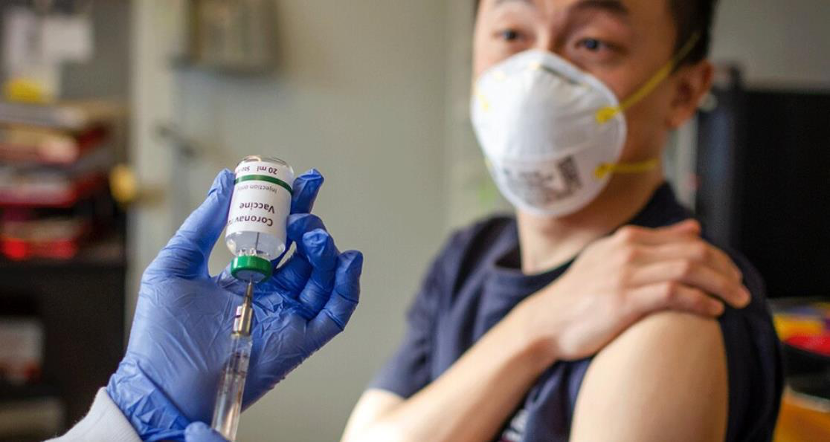
同样受阻的还有受到关注的抗病毒药物瑞德西韦(Remdesivir)。不久前,美国国立卫生研究院(NIH)公布了抗病毒药物瑞德西韦(Remdesivir)的临床结果,虽然在缩短治疗时间上,瑞德西韦优于安慰剂;但在降低死亡率这一重要指标方面,其结果低于统计的可靠性阈值,这意味着结果可能是偶然的,而不是药物的能力。
尽管瑞德西韦属于“老药新用”,但历经多个国家、数月的临床试验,结果并不如人意,那些需要通过从细胞到小鼠、大鼠到灵长类再到人类漫长试验进程的原创新药研发难度更是可想而知了。来自辉瑞、强生、罗氏等医药巨头的统计显示:一款原创新药从研发到上市投入超过10亿美元,时间要花费约10年,药物筛选的失败率更是高达97%,上述提到的赛诺根ARN-509就是那3%的“幸运儿”。
辉瑞/默克:Bavencio头颈癌III期研究失败

2020年3月,辉瑞/默克公司对外表示:抗PD-L1疗法Bavencio治疗头颈癌III期研究因疗效欠佳提前终止。原因是:根据预先计划的中期分析,该研究不太可能达到使无进展生存期(PFS)取得统计学上显著改善的主要终点。
Bavencio属于PD-L1肿瘤免疫疗法,这是当前备受瞩目的一类肿瘤免疫疗法,辉瑞于2014年11月与默克签署高达28.5亿美元协议,进军PD-L1领域。
罗氏:赛诺根(Seragon)SERD乳腺癌药物ARN-810临床已终止

2020年2月,罗氏公司(Roche)透露,2014年以17.25亿美元并购赛诺根制药(Seragon Pharmaceuticals)获得的早期SERD(选择性雌激素受体降解剂)药物ARN-810已经被中止临床试验,而另一个SERD药物RG6171的III期临床试验正在推进中。
仅仅在美国,乳腺癌一年就夺走美国近4万名妇女的生命,其中多达一半由雌激素受体驱动引发。报道称:赛诺根研究的下一代SERD药物既可以阻断雌激素对雌激素受体的作用,也可以从细胞中完全消除雌激素受体。
华尔街机构当时的分析称:赛诺根SERD药物产品作为可口服给药的有效药物,可能成为一款改变乳腺癌治疗游戏规则的产品。
百健(Biogen):阿尔茨海默病药物Aducanumab起死回生

2019年 3 月,美国生物技术公司百健(Biogen)宣布,将停止阿尔茨海默病药物aducanumabIII期临床试验。理由是:Aducanumab对于阿尔茨海默病以及轻度阿尔茨海默病痴呆引起的轻度认知功能损伤没有改善作用,很可能难以到达主要疗效终点。
不过,7个月后,事情迎来了 180 度惊天大逆转:在与美国食品药品监督管理局(FDA)和外部专家讨论之后,百健将计划在 2020 年向 FDA 递交 Aducanumab 的生物制剂许可上市申请(BLA)。
原来,在终止临床试验后,研究人员从研究中获得了更多的数据,从而形成了一个更大的数据集。对这个更大的数据集进行的新的广泛分析,显示出与之前分析预测不一样的结果:III期研究达到了它的主要终点,显示了临床衰退的显著减少。接受Aducanumab 治疗的患者在认知和功能测试(如记忆、定向和语言)方面有显著的改善。
Aducanumab 的起死回生,无异于给抗击阿尔茨海默病的整个群体,包括药企、医生、患者及家属带来振奋人心的新希望。







